und Therapieplanung
Über DocCheck anmelden
Dieses Arzneimittel unterliegt einer zusätzlichen Überwachung. Dies ermöglicht eine schnelle Identifizierung neuer Erkenntnisse über die Sicherheit. Angehörige von Gesundheitsberufen sind
aufgefordert, jeden Verdachtsfall einer Nebenwirkung zu melden. Hinweise zur Meldung von Nebenwirkungen, siehe Abschnitt 4.8 der Fachinformation. Bevor Sie Qarziba® verschreiben, lesen Sie bitte die
vollständige Fachinformation.
Qualitative und quantitative Zusammensetzung: 1 ml Konzentrat enthält 4,5 mg Dinutuximab beta. Jede Durchstechflasche enthält 20 mg Dinutuximab beta in 4,5 ml. Dinutuximab beta ist ein in einer
Säugetierzelllinie (CHO) durch rekombinante DNA-Technologie hergestellter chimärer (Mensch/Maus) monoklonaler IgG1-Antikörper. Vollständige Auflistung der sonstigen Bestandteile: Histidin, Sucrose,
Polysorbat 20, Wasser für Injektionszwecke, Salzsäure (zur pH-Einstellung).
Anwendungsgebiete: Qarziba® wird angewendet für die Behandlung von Hochrisiko-Neuroblastomen bei Patienten im Alter von 12 Monaten und älter, die zuvor eine Induktions- Chemotherapie
erhalten und zumindest eine partielle Remission erreicht haben, gefolgt von myeloablativer Therapie und Stammzelltransplantation. Außerdem wird es angewendet für Patienten mit rezidivierten oder
refraktären Neuroblastomen mit oder ohne Residualerkrankung in der Anamnese. Vor der Behandlung eines rezidivierten Neuroblastoms sind jegliche aktiv progredienten Erkrankungen mithilfe anderer geeigneter
Maßnahmen zu stabilisieren. Bei Patienten mit einer rezidivierten/refraktären Erkrankung in der Anamnese sowie bei Patienten, bei denen nach der Erstlinientherapie kein vollständiges Ansprechen erreicht
wurde, sollte Qarziba® mit Interleukin-2 (IL-2) kombiniert werden.
Gegenanzeigen: Überempfindlichkeit gegen den Wirkstoff oder einen der sonstigen Bestandteile. Akute Graft-versus-host-Reaktion (GvHR), Grad 3 oder 4 oder chronisch „extended“ GvHR.
Verkaufsabgrenzung: Verschreibungspflichtig (Österreich: Rezept- und apothekenpflichtig).
Pharmakotherapeutische Gruppe: Antineoplastische Mittel, monoklonale Antikörper, ATC- Code: L01XC.
Inhaber der Zulassung: Recordati Netherlands B.V., Beechavenue 54, 1119PW, Schiphol-Rijk, Niederlande.
Weitere Informationen: Ausführliche Informationen zu Warnhinweisen und Vorsichtsmaßnahmen für die Anwendung, Wechselwirkungen, Fertilität, Schwangerschaft und Stillzeit, Nebenwirkungen sowie
Dosierung und Art/Dauer der Anwendung entnehmen Sie bitte der veröffentlichten Fachinformation (Zusammenfassung der Merkmale des Arzneimittels).
Stand: März 2021

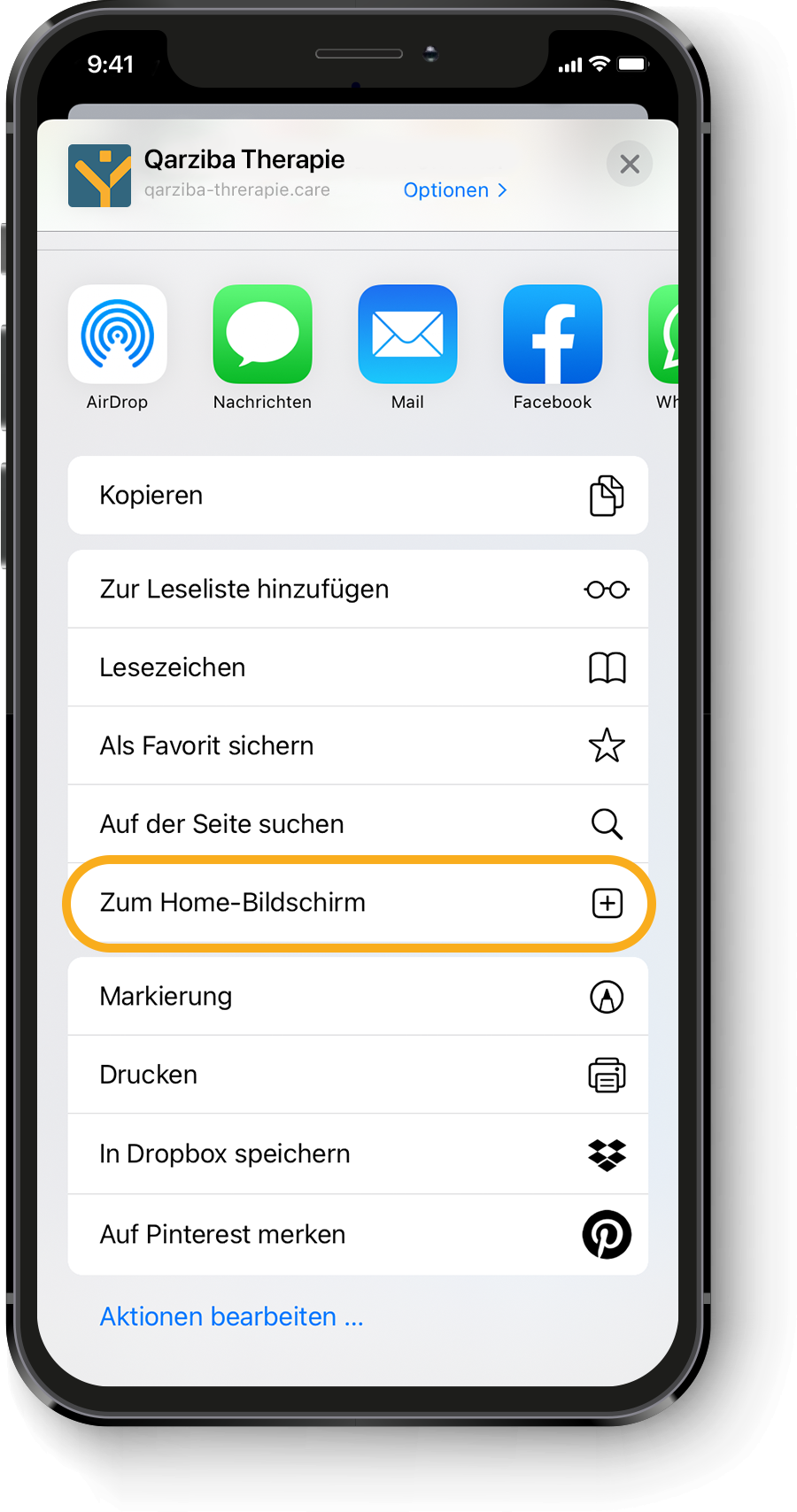
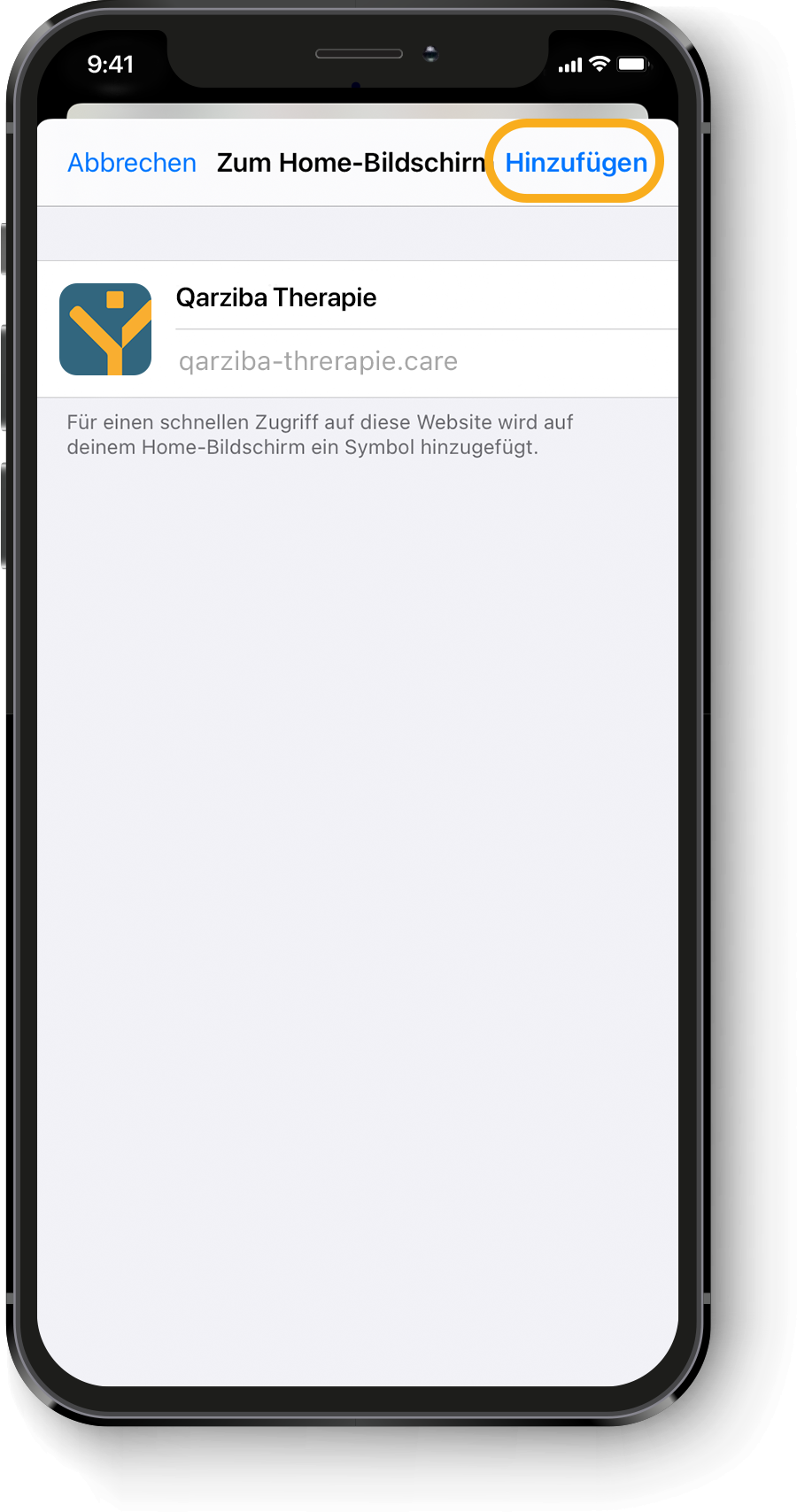


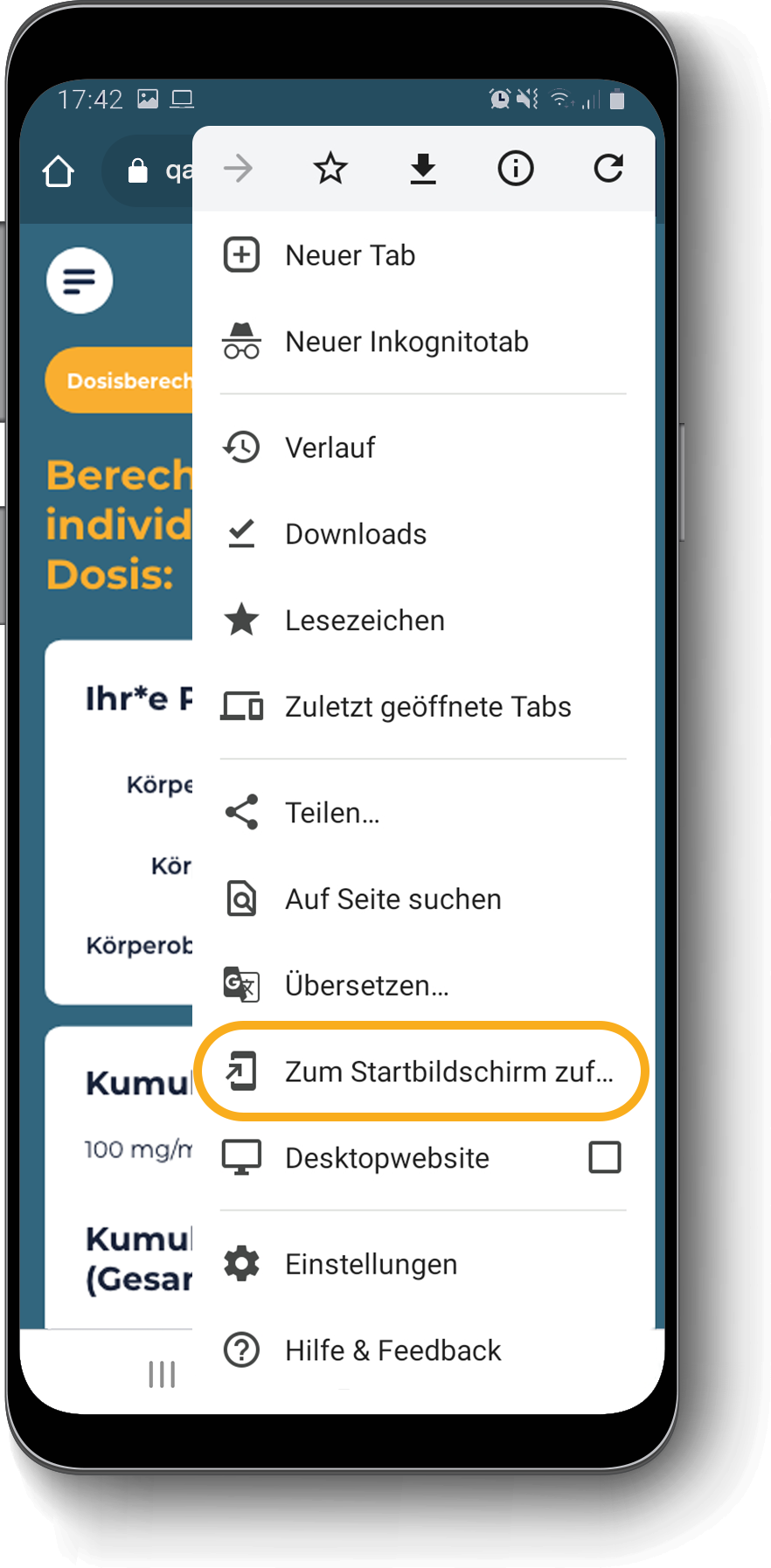
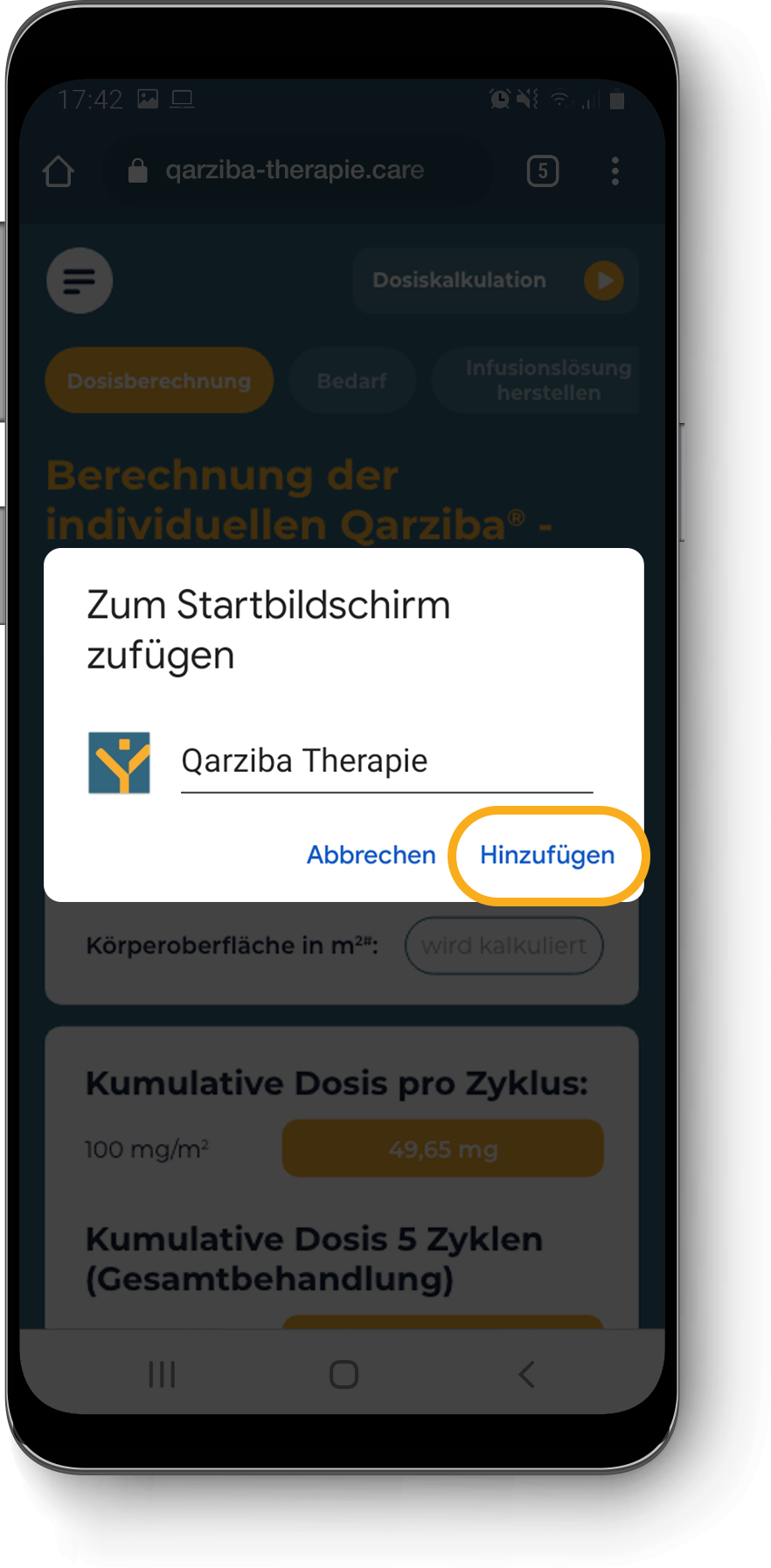

Diese Webapplikation dient der Orientierung und nicht als eine absolute Entscheidungsgrundlage für eine Therapieentscheidung oder -kombination mit Begleitmedikation. Von maßgeblicher Bedeutung bleibt die Prüfung jedes therapeutischen Einzelfalls. Dabei sind die individuellen Gegebenheiten des Patienten vom behandelnden Facharzt einzubeziehen.
Zusätzlich ist jeder Behandler mit Dinutuximab beta (QARZIBA®) verpflichtet, vor Verordnung und Anwendung die Angaben insbesondere anhand der jeweils aktuellen Fachinformation in eigener Verantwortung auf ihre Anwendbarkeit zu überprüfen. Eine Garantie für die absolute Richtigkeit der Angaben in diesem Erklärvideo kann nicht gegeben werden.
Verantwortlich für die wissenschaftliche Redaktion:
Dr. Arshan Perera
Medical Affairs Manager DACH
Impressum/Anbieterkennzeichnung nach § 6 TDG Herausgeber/Dienstanbieter:
Recordati Rare Diseases Germany GmbH
Eberhard-Finckh-Straße 55, 89075 Ulm
Telefon: +49 (0) 731 140 5540, info.de@recordati.com
www.recordatirarediseases.com
Vertretungsberechtigte Geschäftsführer:
Michael Kickuth, Luigi Longinotti
Registergericht: Ulm, Registernummer: HRB727718
Umsatzsteuer-Identifikationsnummer gemäß § 27 a Umsatzsteuergesetz: DE186445281
Zuständige Aufsichtsbehörde:
Regierungspräsidium Tübingen
Konrad-Adenauer-Str. 20, D-72072 Tübingen