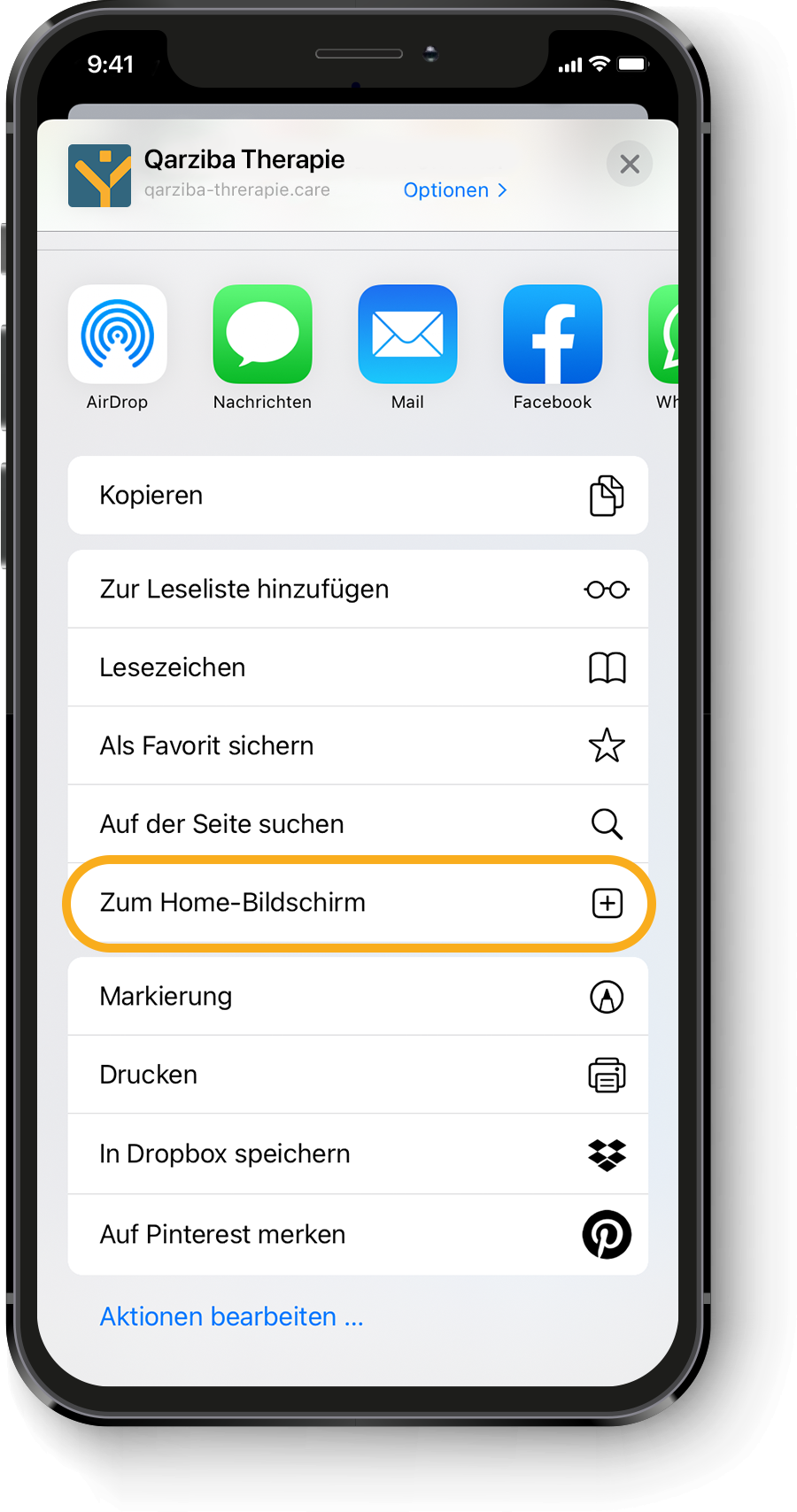
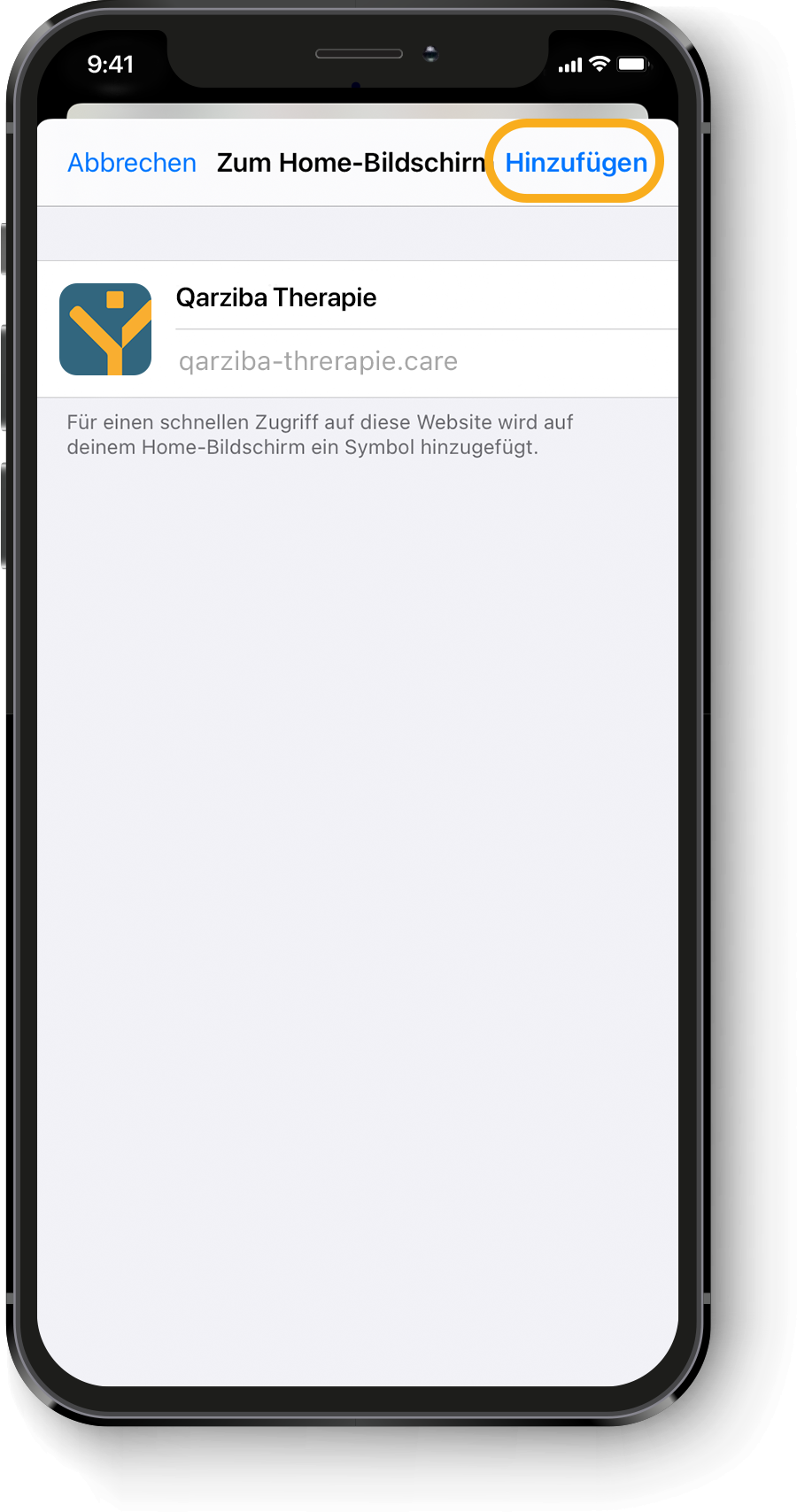
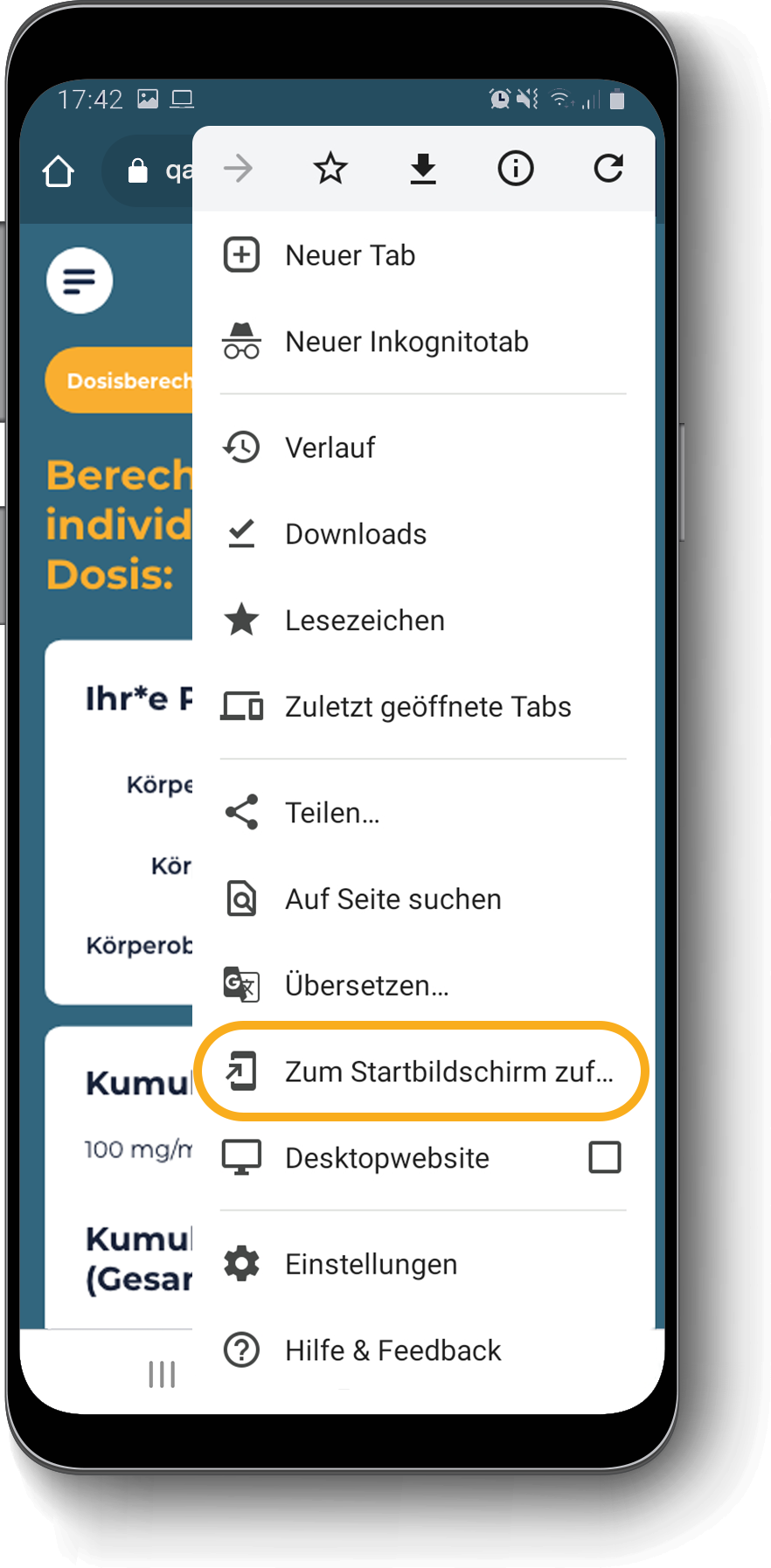
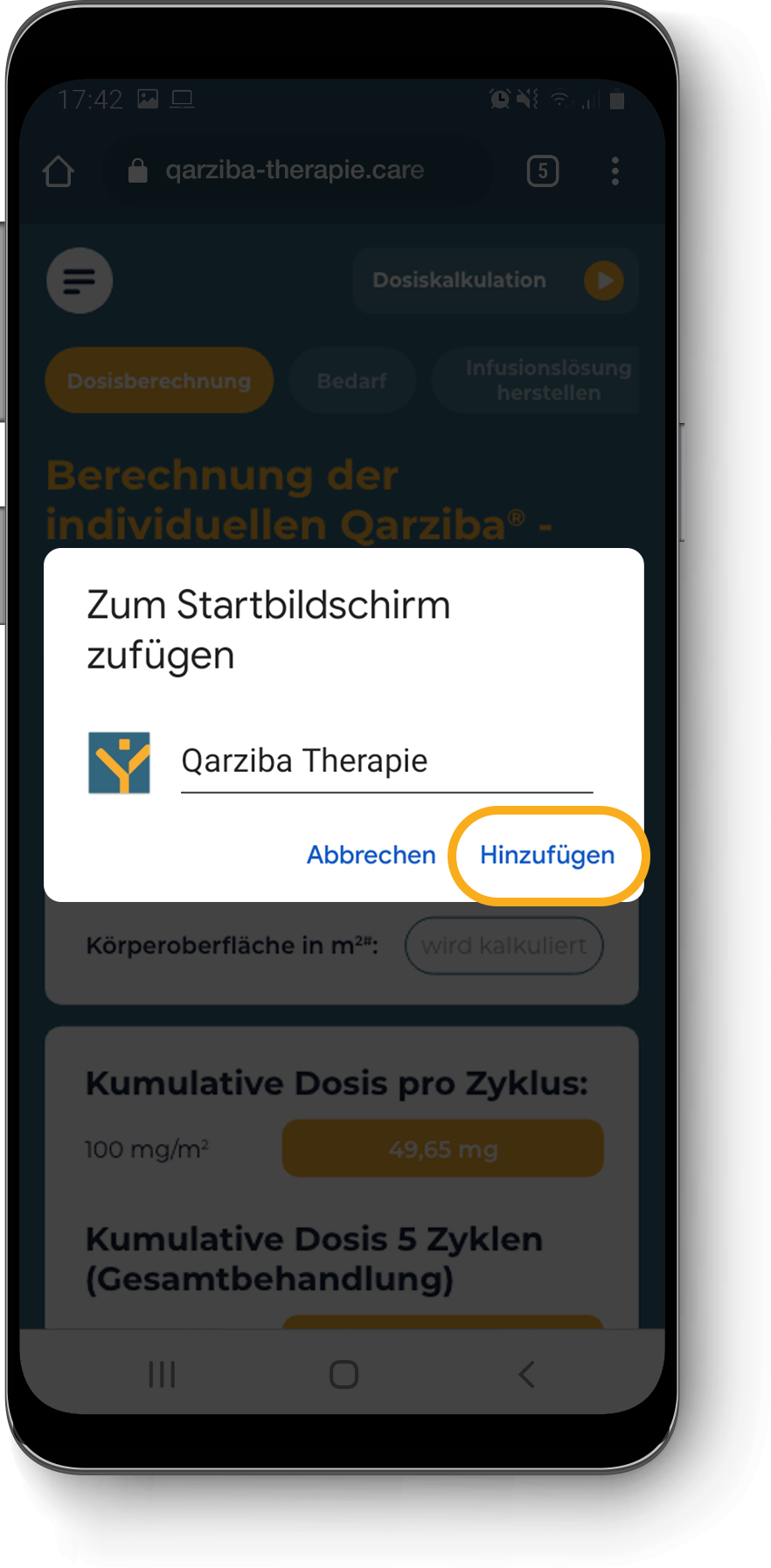
Berechnung der individuellen QARZIBA®-Dosis:
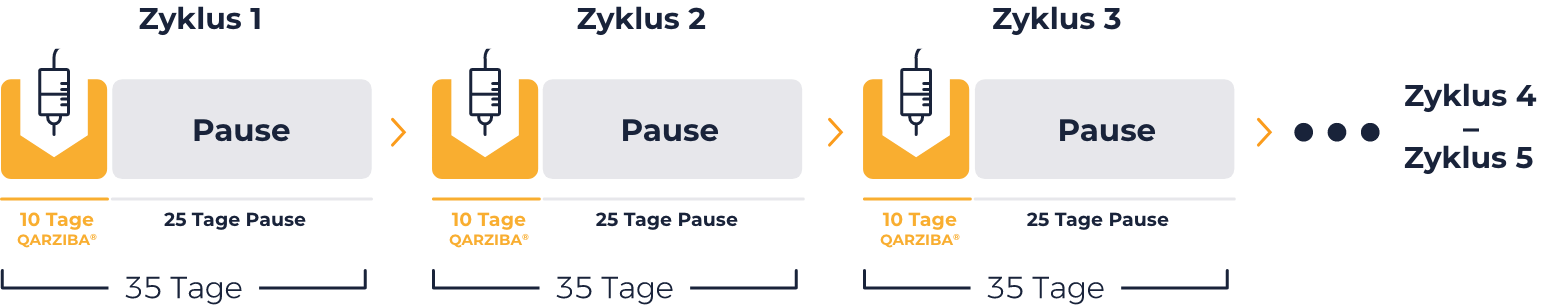
Kumulative Dosis pro Zyklus
Kumulative Dosis 5 Zyklen
(Gesamtbehandlung)
Empfehlung der S1 Leitlinie1
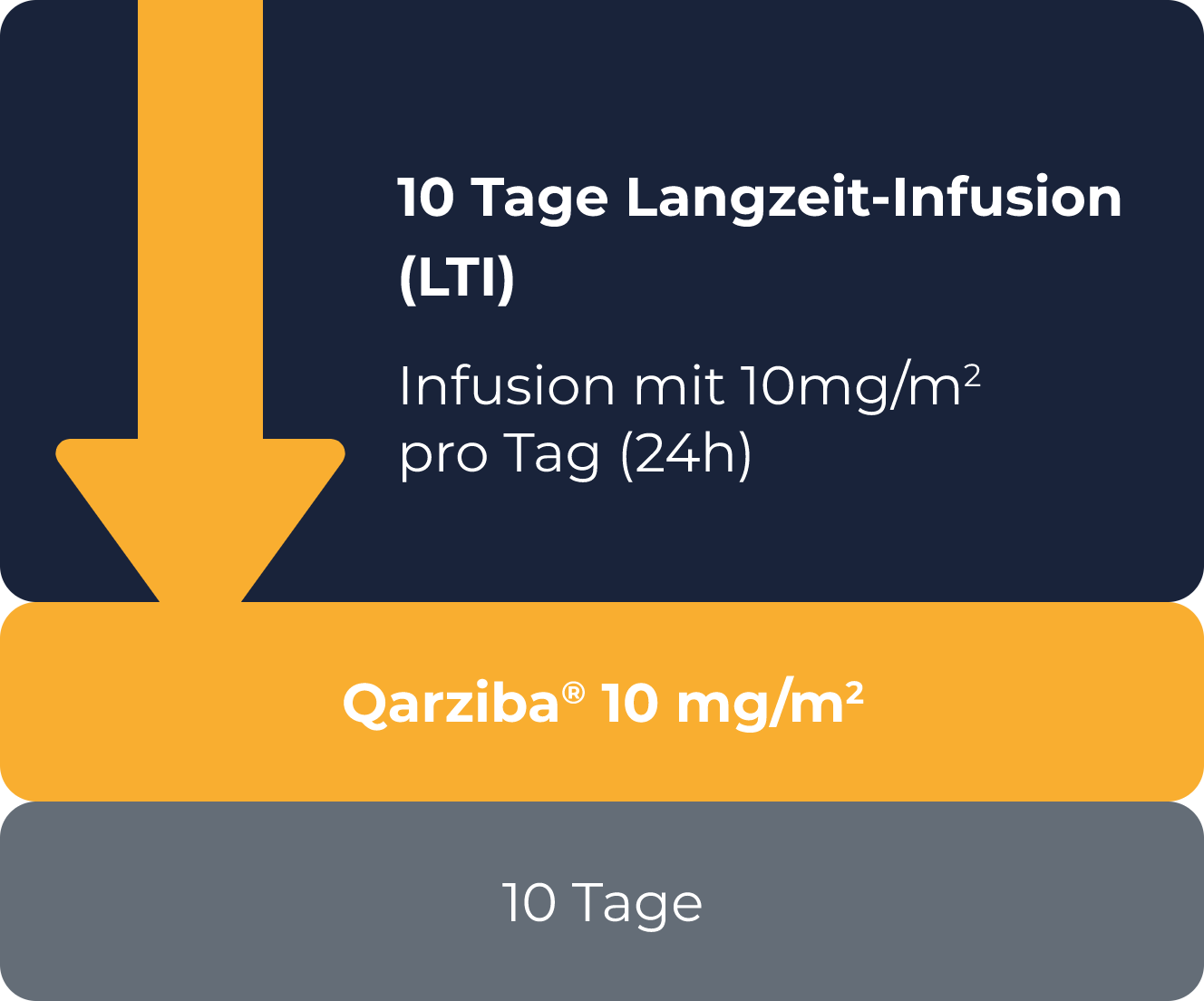
10 Tage
Langzeit-Infusion
Weiter
5 Tage
Kurzzeit-Infusion
Weiter
Berechnung des individuellen QARZIBA®-Bedarfs: LTI#*
pro 5 Zyklen
(Gesamtbehandlung)
#Die Infusionslösung kann für 5 Tage im Voraus
hergestellt werden
*LTI:long-term-infusion; STI:short-term-infusion
**Aus mikrobiologischer Sicht ist das Produkt sofort zu verwenden. Wenn es nicht sofort verwendet wird, liegen die Lagerzeiten und Lagerbedingungen im Gebrauch in der Verantwortung des Anwenders; sie betragen in der Regel nicht mehr als 24 Stunden bei 2 °C bis 8 °C, es sei denn, die Verdünnung ist unter kontrollierten und validierten aseptischen Bedingungen erfolgt (QARZIBA Fachinformation).
pro 5 Zyklen
(Gesamtbehandlung)
#Die Infusionlösung kann für 5 Tage im Voraus
hergestellt werden
*LTI:long-term-infusion; STI:short-term-infusion
Dosis
Anzahl
Durchstechflaschen**
Berechnung der erforderlichen Menge
QARZIBA®-Lösung: LTI
=
0,4965 m² x 10mg/m²/Tag x 1,042*
4,5 mg/ml QARZIBA®-Konzentration
Berechnung der erforderlichen Menge 0,9% NaCl-Lösung
-2,5 ml
Humanalbumin (20%)
-1,15 ml
QARZIBA®- Lösung (4,5 mg/ml)
Fertige Infusionlösung
pH-Wert von 6,6
Osmolarität 283 mOsmol/kg
* Totvolumen des Infusionsbeutels
Ihr individuelles Dosisschema: LTI1*
QARZIBA® 4,965 mg pro
Tag
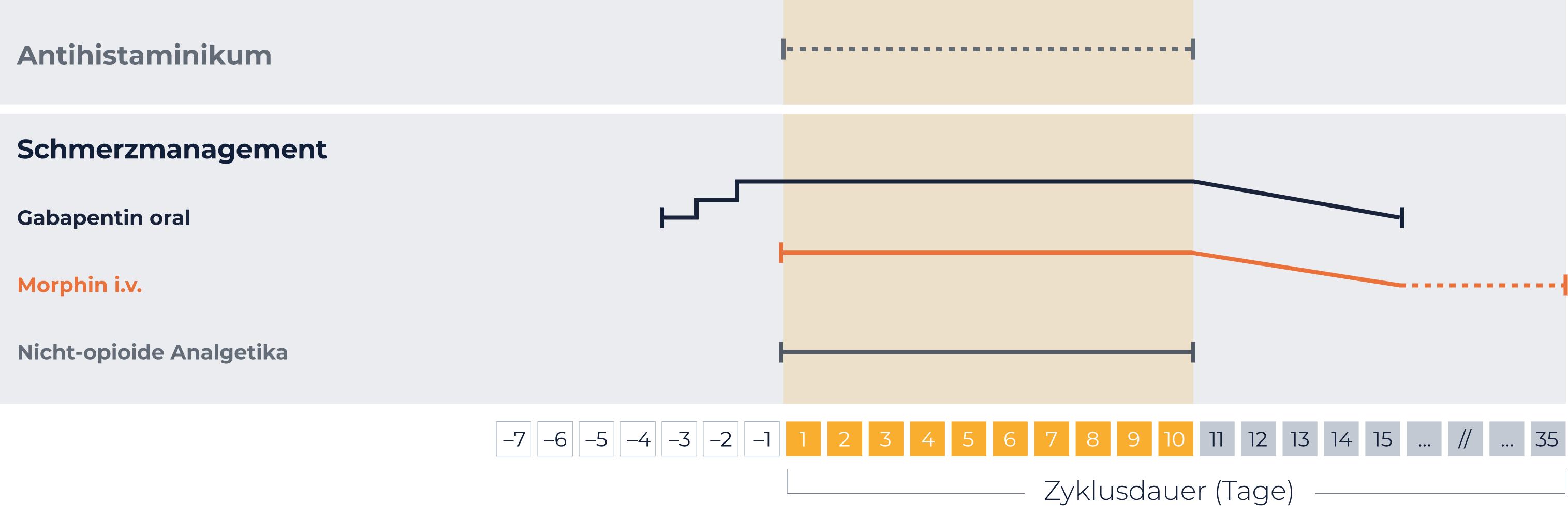
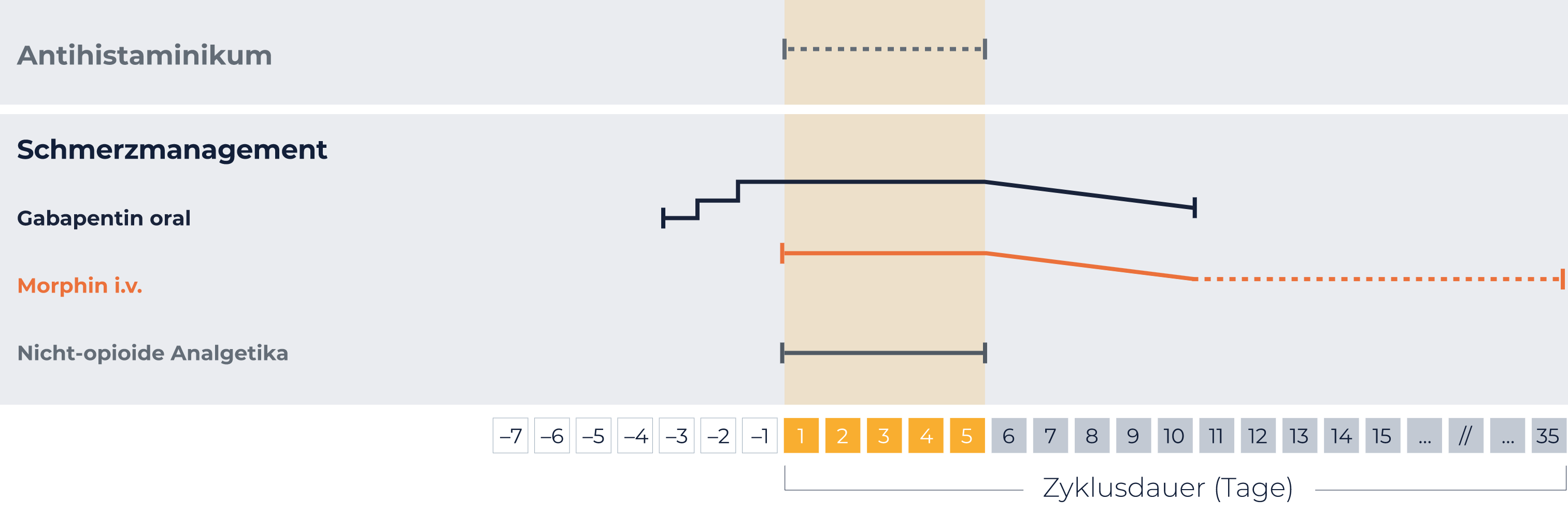
Antihistaminikum
20 min vor jeder QARZIBA®-Infusion
Bei Bedarf alle 4-6 std während der Infusion wiederholen
Gabapentin
3 Tage vor QARZIBA®: 1x 102 mg
2 Tage vor QARZIBA®: 2x 2x 102 mg
1 Tag vor QARZIBA®: 3x 102 mg
Opioide
Morphin i.v. vor
QARZIBA®-Gabe:
Bolus (0,204 - 0,510 mg/h) 2 std
vorher
Während
QARZIBA®-Gabe:
Fortführen mit 0,306 mg/h
Alternativ:
Morphinsulfat, Tramadol
Nichtopioidanalgetika
Zum Beispiel Paracetamol und Ibuprofen
Gabe durchgehend während
der Behandlung mit QARZIBA®
1 Berechnungen nach der aktuellen QARZIBA®-Fachinformation sowie den WHO-
Leitlinien (Stand 2017), Gabe von Interleukin-2, wenn indiziert.
#LTI:Long-term infusion; STI:Short-term-infusion
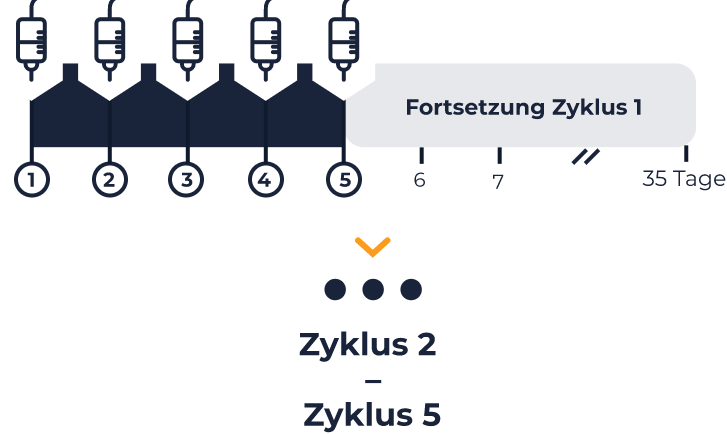
QARZIBA® Langzeit-Infusion jeweils von Tag 1-10
1x 102 mg/Tag,
2x 2x 102 mg/Tag,
3x 102 mg/Tag

Maximale Einzeldosis 300 mg. Dieses Dosierungsschema sollte so lange beibehalten
werden, wie dies für den Patienten erforderlich ist.
Ausschleichen nach der Entwöhnung von intravenösen Morphin-Infusionen,
jedoch spätestens nach Ende der Behandlung mit Dinutuximab beta-Infusionen.
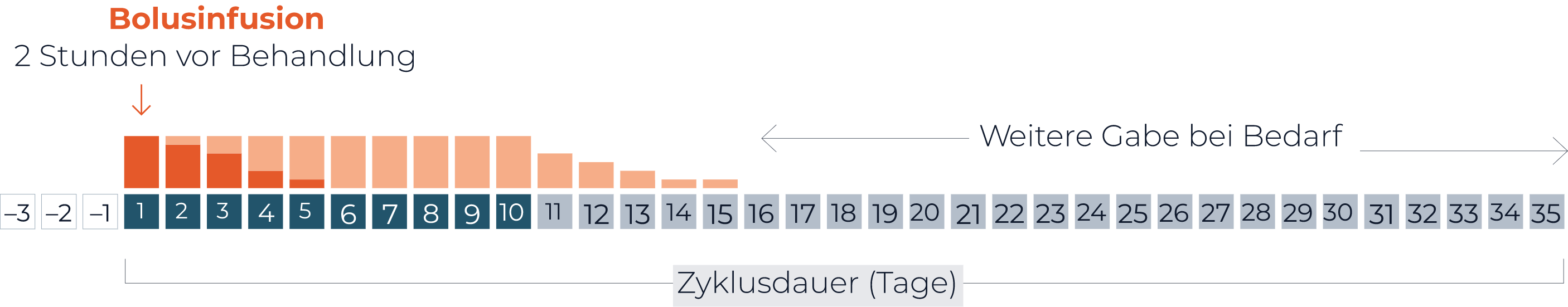
Morphin als Bolusinfusion mit 0,02 bis 0,05 mg/kg/Stunde 2 Stunden vor Beginn der
Dinutuximab beta-Dauerinfusion.
Anschließend mit Dosisrate von 0,03 mg/kg/Stunde gleichzeitig mit der
Dinutuximab beta-Infusion.
Ggf. stundenweise Entwöhnung je nach Schmerzsituation.
Bedarfmedikation Opioide (nach Morphin-Entwöhnung)
- Schwere neuropatische Schmerzen: orales Morphinsulfat (0,2 mg/kg/ bis 0,4 mg/kg
alle 4 bis 6 Stunden)
- Mäßige neuropathische Schmerzen: orales Tramadol

Wärend der Behandlung mit Dinutuximab beta sollten durchgehend
Nichtopioid-Analgetika, wie z.B. Paracetamol oder Ibuprofen, angewandt werden.